Autorizan el uso de emergencia de la primera prueba casera de COVID-19
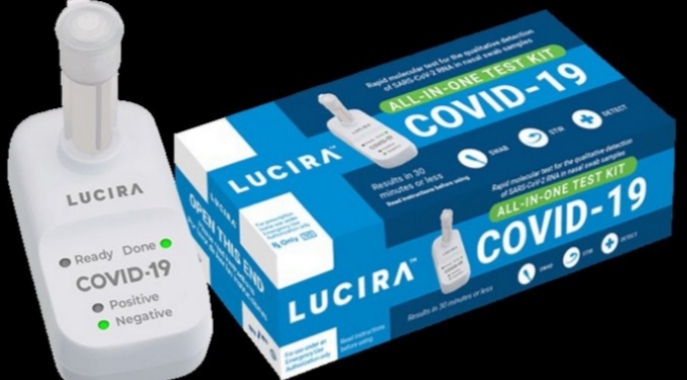
Las autoridades de la Administración de Alimentos y Medicamentos de Estados Unidos (FDA por sus siglas en inglés) autorizaron el uso de emergencia de la primera prueba rápida de COVID-19 que puede hacerse en casa y ofrece resultados en 30 minutos.
En un esfuerzo por ampliar las opciones de pruebas diagnósticas de COVID-19 más allá de los centros de salud y puntos de pruebas, las autoridade reguladoras estadounidenses autorizaron el kit de un sólo uso de Lucira Health, un fabricante de California.
Aunque, la prueba requerirá prescripción médica, lo que probablemente limitará su uso inicial.
La prueba de la compañía permite a los usuarios tomar ellos mismos una muestra nasal.
Hasta ahora, la FDA ha autorizado casi 300 pruebas diagnósticas de coronavirus. La gran mayoría requiere que un profesional sanitario tome las muestras en la nariz y deben procesarse en laboratorios.
¿Cómo funciona?
El kit, de la compañía Lucira, es una prueba molecular de un solo uso.
La persona se toma la muestra nasal y posteriormente frota el hisopo nasal en un vial con una solución de laboratorio que se conecta a un dispositivo portátil. Los resultados se muestran como luces de colores identificadas como positiva o negativa.
La prueba Lucira Covid-19 All-In-One Test Kit ha sido autorizada para su uso en el hogar con muestras de hisopado nasal en personas de 14 años o más que son sospechosas de tener COVID-19 por su médico.
También está autorizado para su uso en consultorios médicos, hospitales y centros de atención urgente.
Las pruebas rápidas son cruciales para poner en cuarentena con rapidez a los infectados y rastrear sus contactos.
El test utiliza una tecnología similar a las pruebas de laboratorio basadas en información genética que son la herramienta estándar para detectar el nuevo coronavirus.
Según informó la compañía, en un estudio de pruebas en el que se comparó su prueba con una de alta sensibilidad autorizada por la FDA, su test logró un 94% de acuerdo porcentual positivo (PPA) y un 98% de acuerdo porcentual negativo (NPA). Excluyendo las muestras con niveles muy bajos de virus que posiblemente ya no reflejaban una infección activa1, Lucira logró un acuerdo porcentual positivo del cien por cien.
“Ahora, más estadounidenses que podrían tener COVID-19 podrán tomar medidas de inmediato, basándose en sus resultados, para protegerse a sí mismos y a su entorno”, dijo en un comunicado el doctor Jeff Shuren, director del centro de dispositivos de la FDA.
Esta es la primera que puede ser totalmente autoadministrada y proporcionar resultados en el hogar, comentó el comisionado de la FDA.


Comentarios recientes